進行中のテーマ
進行中のテーマ
1)膵β細胞におけるインスリン顆粒開口放出機構
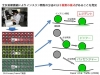
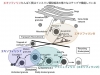
糖尿病の成因、特に日本人のそれには、インスリン分泌不全が大きく関与します。インスリン顆粒を蛍光標識し、生きた膵β細胞でリアルタイムに開口放出現象を可視化しますと、膜融合直前の顆粒の細胞内動態は一様ではなく、細胞膜からの距離や細胞膜近傍での停留時間がさまざまな顆粒からの開口放出が認められました(Traffic 2008; 図1)。私たちは、インスリン顆粒膜に局在するGranuphilinを同定し、本分子がインスリン顆粒の細胞膜ドッキングに必須であるのみならず、次の膜融合反応を抑制することを発見しました(J. Biol. Chem. 1999; Mol. Cell. Biol. 2002a; J. Biol. Chem. 2004; J. Cell. Biol. 2005; J. Biol. Chem. 2011; 図2)。また、膵β細胞は、グルコースなどの栄養素代謝を介して分泌を引き起こす点に特徴がありますが、Rab27aおよびGranuphilinが、栄養素による分泌シグナルの作用点であることを見出しました(J. Clin. Invest. 2005; Cell Metab. 2006)。さらに最近、Granuphilinと類似構造を持つExophilin7という分子が、細胞膜にドッキングしていないインスリン顆粒の開口放出に関与していることを報告しました(Mol. Biol. Cell 2013; 図2)。このように、野生型や遺伝子欠損マウスに由来する、生きた分泌細胞で、分泌顆粒の動態とその分子基盤を研究しています。
図1 全反射顕微鏡によりインスリン顆粒の分泌には3種類の様式があることを発見
図2 エキソフィリンたんぱく質はインスリン顆粒輸送の様々なステップで機能している
2)調節性分泌経路におけるRab27a/bおよびそのエフェクター分子Exophilinsの役割
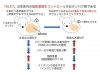
Granuphilin は低分子量GTPase Rab27aまたはRab27bのエフェクターとして機能していますが、私たちは、Rab27a/bが、さまざまな細胞内小胞膜輸送経路のうち、刺激に応じて生理活性物質や膜タンパク質を細胞外に分泌・表出させる調節性分泌経路に特異的に機能していることを見出しました(Mol. Cell. Biol. 2002b; Mol. Biol. Cell 2007a)。GTPと結合した活性型Rab27a/bは、Granuphilinと類似構造を持つExophilinsファミリー分子を介して、さまざまな分化細胞の調節性分泌経路を制御しています(FEBS Lett. 2002; 図3)。実際、当研究室では、Exophilin4は、膵α細胞グルカゴン顆粒の細胞膜ドッキングに関与すること(Mol. Biol. Cell 2007b)、Exophilin8は、刺激依存性に細胞内部から細胞膜近傍へ分泌顆粒を供給すること(Mol. Biol. Cell 2011; 図2)、また、X染色体上にあるGranuphilin遺伝子の発現は、視床下部において著明な性差を示し、本遺伝子が性特異的な行動を制御していること(Cell 2012)、などを示してきました。現在、上記とは別のRab27エフェクター分子が膵β細胞をはじめとする内分泌細胞で分泌顆粒の生成や開口放出にどのような役割を果たしているかを解析しています。また、Rab27a/bやそのエフェクター遺伝子の変異マウスを用いて、調節性分泌の異常が、免疫アレルギー疾患や呼吸器疾患などの病態に及ぼす影響を調べる研究も開始しています。
図3 様々な分泌細胞において機能する、Rab27エフェクターファミリー「エキソフィリン(Exophilin)」
3)動物モデルを用いた、糖尿病・肥満の成因や病態生理
これまで常染色体優性遺伝様式を示す糖尿病モデルAkitaマウスが、インスリン2分子A鎖第7番目システイン残基のチロシン残基への変異を有し、これにより高度の耐糖能障害が引き起こされていることを発見しました(J. Clin Invest. 1999; Diabetes 2003)。分子内A7-B7間のジスルフィド結合が形成されなくなる変異プロインスリン分子は、小胞体からゴルジ体以降に輸送されず、細胞外に分泌されなくなります。この知見は、小胞体ストレスによる膵β細胞障害の最初の報告であるのみならず、同様のインスリン遺伝子異常がヒト新生児糖尿病の原因となるという発見の先駆けとなりました。
また、多因子性糖尿病・肥満モデルTSODマウスの解析を行い、その血糖値・体重・インスリン値などを制御する遺伝子の染色体上局在部位を複数特定しました(Diabetes 1999; Mamm. Genome 2006)。このうち、脂質蓄積に関わる第2染色体の遺伝子に関しては、ALK7というTGFbeta受容体に属する分子をコードする遺伝子の変異によることを発見しました(Diabetes 2013; 図4)。さらに、ALK7が、脂肪分解を抑制することにより脂肪を蓄積させる働きがあることを見出しました。現在、ALK7に結合するリガンドや、ALK7キナーゼの下流で働くシグナル分子が、脂肪蓄積や肥満症の病態にどのように関わっているかを解析しています。
図4 「ALK7」は生体内の脂肪蓄積をコントロールするタンパク質である